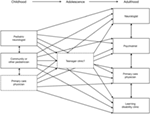
Figura 2. Esquema que ilustra la creciente dispersión de la prestación de atención después de la transición de los servicios pediátricos a los adultos (3). Reproducido con permiso de John Libbey Eurotext.,
otras consideraciones para el manejo del SLG
Los pacientes con síndrome de Lennox–Gastaut se ven afectados en su vida diaria no solo por una variedad de tipos de convulsiones que a menudo son frecuentes y dañinas físicamente (como ataques de caída), sino también por una variedad de comorbilidades graves (3). Las comorbilidades que están particularmente asociadas con el SLG incluyen problemas cognitivos y conductuales, discapacidad física y trastornos del sueño., Cinco años después de la aparición del GL, 75-95% de los pacientes tienen deterioro cognitivo (101, 102) y problemas de comportamiento, como hiperactividad, agresividad y rasgos autistas, se desarrollan en aproximadamente 50% (10). La movilidad a menudo se ve gravemente afectada por convulsiones frecuentes (en particular ataques de caída), que son físicamente exigentes y a menudo resultan en lesiones (3). Los pacientes a menudo tienen que hacer uso de equipo de protección (como una silla de ruedas, casco y/o protector facial) para minimizar los efectos físicos de las convulsiones. A veces el uso de equipos de protección (p. ej.,, permanecer en una silla de ruedas para proteger contra lesiones por ataques de caída) puede afectar la movilidad de los pacientes, alimentando un círculo vicioso que limita su capacidad de ser físicamente activo. Además, el desarrollo temprano de disfagia está fuertemente asociado con un mal pronóstico de convulsiones a largo plazo (103), y afecta la capacidad de los pacientes para comer y tomar medicamentos.
Los pacientes con SLG sufren interrupción del ciclo del sueño debido a la aparición de convulsiones en la noche., La privación del sueño y / o la interrupción afectan los mecanismos neurofisiológicos y neuroquímicos importantes para el proceso de aprendizaje de la memoria (104), y también pueden resultar en una amplia gama de alteraciones conductuales, cognitivas y del Estado de ánimo, incluyendo hiperactividad, calificaciones escolares reducidas y depresión (105).
el manejo cuidadoso de las comorbilidades en el SLG es un aspecto central de la atención. Algunos Dea pueden causar o exacerbar comorbilidades (p. ej.,, deterioro cognitivo, depresión), y la elección del tratamiento DEA por lo tanto debe tener en cuenta esta posibilidad; por ejemplo, las benzodiacepinas utilizadas para tratar los trastornos del sueño pueden precipitar convulsiones tónicas en LGS (106). También se debe considerar cuidadosamente la posibilidad de interacciones farmacológicas de DEA con medicamentos utilizados para el tratamiento de las comorbilidades.,
como resultado de la carga sustancial de convulsiones y comorbilidades, y los efectos secundarios de los medicamentos asociados, la CV de los pacientes con SLG se ve afectada en muchos niveles (físico, mental, social) a lo largo de su vida (3). El impacto físico de LGS, y las medidas preventivas tomadas para minimizar este impacto, afectan gravemente la capacidad de los pacientes para participar en las actividades diarias, y la asistencia a la escuela a menudo se interrumpe. Los problemas cognitivos y conductuales a menudo requieren necesidades educativas y de atención específicas que evitarán la asistencia a la escuela ordinaria (3)., Además, el mencionado impacto de las convulsiones nocturnas en el sueño puede afectar directamente la CV de los pacientes (107). Los efectos del SLG sobre la independencia, la capacidad de trabajo, la participación social y las relaciones personales continúan afectando gravemente la CV de los pacientes hasta la edad adulta (3).,impacto de la RJ en la CV de los padres / cuidadores y las familias debido a la restricción de la vida social y los problemas de relación entre la pareja y otros miembros de la Familia; Sentimientos de aislamiento, que pueden conducir a la depresión; problemas con el cuidado de los niños, que pueden restringir aún más la participación social y las oportunidades de descanso; agotamiento físico y/o trastornos del sueño; ansiedad sobre cuándo ocurrirán las convulsiones, las perspectivas futuras del individuo con SLG y el estigma social asociado con la condición; así como dificultades financieras resultantes de renunciar al desarrollo profesional en favor del cuidado (108).,
dado que el SLG constituye una carga importante para los pacientes y sus cuidadores/familias, se requiere un enfoque multidisciplinario e individualizado del cuidado, que aborde las necesidades médicas, educativas, psicológicas y sociales de cada paciente a lo largo de su vida (109). Idealmente, las necesidades del paciente y de su cuidador/familia deberían ser reevaluadas anualmente, teniendo en cuenta factores como la salud física del paciente, su posible necesidad de institucionalización (particularmente en la edad adulta) y el apoyo al cuidador/familia.,
áreas para futuras investigaciones
en la actualidad, los Dea son medicamentos anticonvulsivos y, por lo tanto, tratan los síntomas de la epilepsia en lugar de su causa(s). La investigación futura debe centrarse en elucidar la historia natural de la LGS y si el tratamiento adecuado puede tener un impacto beneficioso en el curso de su enfermedad. Esto no solo debe incluir los efectos del tratamiento farmacológico, sino también el papel de los procedimientos quirúrgicos como la callosotomía., Se ha sugerido que el control temprano de las convulsiones en el GL está asociado con mejores resultados neurocognitivos (2), pero la relevancia de esto en el GL de novo, así como el impacto de la supresión de las convulsiones en niños mayores y adultos, es menos cierta y es un área que merece un estudio más detenido. Aunque actualmente se presta atención a los posibles efectos perjudiciales de los DEA en la cognición, se requiere investigación para dilucidar si otros tratamientos no DEA pueden proteger contra el deterioro cognitivo y/o mejorar la cognición en pacientes con GL., Además, se necesita investigación para desarrollar herramientas estandarizadas para que los cuidadores midan rutinariamente los cambios en el rendimiento cognitivo y el comportamiento de los pacientes a lo largo del tiempo. También es necesario dilucidar si existen genotipos específicos o mutaciones genéticas que determinen una susceptibilidad a LGS, lo que podría orientar el desarrollo de herramientas diagnósticas.
dados los problemas asociados con el conteo de las convulsiones en LGS (debido a la frecuencia de ataques de caída, duración de las convulsiones de ausencia, etc.,), se debe evaluar el valor predictivo del uso de criterios de valoración alternativos en la investigación de ensayos clínicos, como el número de días sin convulsiones, en lugar de la frecuencia de las convulsiones per se. La caracterización de los factores que predicen la respuesta al tratamiento en pacientes con SLG también sería valiosa en el ámbito de la investigación y la práctica clínica. Otras áreas potenciales de investigación futura incluyen la relevancia de la terapia con esteroides en LGS, y si puede mejorar la cognición , y los efectos a largo plazo del tratamiento con cannabidiol en LGS, en términos de EA y el desarrollo potencial de tolerancia.,
contribuciones de los autores
todos los autores (JC, SA, MF, PS y AA) hicieron contribuciones sustanciales a la concepción de este artículo y al análisis e interpretación de los datos que contiene; participaron en la redacción del artículo o la revisión crítica de su contenido intelectual importante; proporcionaron la aprobación final de la versión que se publicará; y acordaron rendir cuentas de todos los aspectos del trabajo para garantizar que las preguntas relacionadas con la exactitud o integridad de cualquier parte del trabajo se investigaron y resolvieron adecuadamente.,
Declaración de conflicto de intereses
JC ha formado parte de las juntas consultivas de Eisai, UCB, Shire, Zogenix, Vitaflo y Nutricia, por las que se han pagado pagos y honorarios a su departamento. Ha participado como investigadora para Vitaflo, GW Pharmaceuticals y Zogenix, con fondos pagados a su departamento. También ha recibido fondos de Investigación de Vitaflo. Es apoyada por el National Institute for Health Research Biomedical Research Centre en Great Streetond Street Hospital For Children NHS Foundation Trust y University College London., SA ha formado parte de los consejos consultivos de Eisai, GSK, Novartis, Nutricia, Shire, Ultragenyx y Zogenix. Ha participado como investigador para Advicenne Pharma, Eisai, UCB, Ultragenyx y Zogenix, con fondos pagados a su hospital o su laboratorio de investigación. MF ha participado como investigadora para UCB, GW Pharmaceuticals, Pfizer y LivaNova, con fondos pagados a su departamento. Ha recibido fondos de Investigación de Eisai, UCB, LivaNova y Esteve, con fondos pagados a su departamento. Ha recibido honorarios de oradores de Eisai, UCB, LivaNova, Bial y Esteve., PS recibió honorarios de FB Health, Kolfarma s. r. l., UCB Pharma y Eisai Inc., y el apoyo a la investigación del Ministerio de salud italiano y la Fundación Teletón. AA ha recibido becas de investigación de la Comisión Europea, UCB Pharma y CaixaBank, con fondos pagados a su departamento y honorarios de consultoría de Eisai, GW, Shire, Takeda, Zogenix y UCB Pharma.
agradecimientos
El apoyo Editorial para la preparación de este manuscrito fue proporcionado por John Scopes de MXM Medical Communications.,
financiación
la reunión del grupo de consenso para el desarrollo de esta publicación fue organizada y financiada por Eisai Ltd. El apoyo Editorial para la preparación de esta publicación fue financiado por Eisai Ltd. Las opiniones expresadas en este artículo son las opiniones de consenso independientes de los autores y no han sido influenciadas por el patrocinio de terceros.
Abreviaturas
Notas a pie de página
2. Arzimanoglou A, Resnick T. todos los niños que sufren caídas epilépticas no tienen necesariamente el síndrome de Lennox-Gastaut but pero muchos sí., Epileptic Disord (2011) 13(Suppl 1):S3–13. doi:10.1684/epd.2011.0422
CrossRef Full Text | Google Scholar
3. Kerr M, Kluger G, Philip S. Evolution and management of Lennox-Gastaut syndrome through adolescence and into adulthood: are seizures always the primary issue? Epileptic Disord (2011) 13(Suppl 1):S15–26. doi:10.1684/epd.2011.0409
PubMed Abstract | CrossRef Full Text | Google Scholar
5., Goldsmith IL, Zupanc ML, Buchhalter JR. Long-term seizure outcome in 74 patients with Lennox-Gastaut syndrome: effects of incorporating MRI head imaging in defining the cryptogenic subgroup. Epilepsia (2000) 41(4):395–9. doi:10.1111/j.1528-1157.2000.tb00179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes., Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia (1989) 30(4):389–99. doi:10.1111/j.1528-1157.1989.tb05316.x
CrossRef Full Text | Google Scholar
10. van Rijckevorsel K. Treatment of Lennox-Gastaut syndrome: overview and recent findings. Neuropsychiatr Dis Treat (2008) 4(6):1001–19. doi:10.2147/NDT.,S1668
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gastaut H, Dravet C, Loubier D. Evolution clinique et prognostic du syndrome de Lennox-Gastaut. In: Lugaresi E, Pazzaglia P, Tassinari CA, editors. Evolution and Prognosis of Epilepsies. Bologna, Italy: Aulo Gaggi (1973). p. 133–54.
Google Scholar
17. EuroEPINOMICS-RES Consortium, Epilepsy Phenome/Genome Project, Epi4K Consortium., De novo mutations in synaptic transmission genes including DNM1 cause epileptic encephalopathies. Am J Hum Genet (2014) 95(4):360–70. doi:10.1016/j.ajhg.2014.08.013
CrossRef Full Text | Google Scholar
18. Epilepsy Phenome/Genome Project Epi4K Consortium. Copy number variant analysis from exome data in 349 patients with epileptic encephalopathy. Ann Neurol (2015) 78(2):323–8. doi:10.1002/ana.,24457
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Larsen J, Johannesen KM, Ek J, Tang S, Marini C, Blichfeldt S, et al. The role of SLC2A1 mutations in myoclonic astatic epilepsy and absence epilepsy, and the estimated frequency of GLUT1 deficiency syndrome. Epilepsia (2015) 56(12):e203–8. doi:10.1111/epi.13222
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Hughes JR, Patil VK., Long-term electro-clinical changes in the Lennox-Gastaut syndrome before, during, and after the slow spike-wave pattern. Clin Electroencephalogr (2002) 33(1):1–7. doi:10.1177/155005940203300103
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Doose H. Myoclonic-astatic epilepsy. Epilepsy Res Suppl (1992) 6:163–8.
PubMed Abstract | Google Scholar
26. Patry G, Lyagoubi S, Tassinari CA., Subclinical «electrical status epilepticus” induced by sleep in children. A clinical and electroencephalographic study of six cases. Arch Neurol (1971) 24(3):242–52. doi:10.1001/archneur.1971.00480330070006
CrossRef Full Text | Google Scholar
28. King DW, Smith JR. Supplementary sensorimotor area epilepsy in adults. Adv Neurol (1996) 70:285–91.
PubMed Abstract | Google Scholar
29., Khan SA, Carney PW, Archer JS. Breve postura tónica asimétrica con actividad rápida difusa de bajo voltaje en crisis provenientes de la región mesial parietal. Epilepsia Res (2014) 108(10):1950-4. doi: 10.1016 / j. eplepsyres.2014.09.011
PubMed Abstract | CrossRef Texto Completo | Google Scholar
33. Síndrome de Ohtahara S. Lennox-Gastaut. Consideraciones en su concepto y categorización. JPN J Psiquiatría Neurol (1988) 42(3):535-42.,
PubMed Abstract | Google Scholar
35. Pujar S, Calvert S, Cortina-Borja M, Chin RF, Smith RA, Cross JH, et al. Statistical process control (SPC) – a simple objective method for monitoring seizure frequency and evaluating effectiveness of drug interventions in refractory childhood epilepsy. Epilepsy Res (2010) 91(2–3):205–13. doi:10.1016/j.eplepsyres.2010.07.013
CrossRef Full Text | Google Scholar
39., Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry (2006) 77(2):193–8. doi:10.1136/jnnp.2005.074203
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Motte J, Trevathan E, Arvidsson JF, Barrera MN, Mullens EL, Manasco P, et al. Lamotrigine for generalized seizures associated with the Lennox-Gastaut syndrome., N Engl J Med (1997) 337(25):1807–12. doi:10.1056/NEJM199712183372504
CrossRef Full Text | Google Scholar
46. The Felbamate Study Group in Lennox-Gastaut Syndrome. Efficacy of felbamate in childhood epileptic encephalopathy (Lennox-Gastaut syndrome). N Engl J Med (1993) 328(1):29–33. doi:10.1056/NEJM199301073280105
CrossRef Full Text | Google Scholar
52., Ohtsuka y, Yoshinaga H, Shirasaka y, Takayama R, Takano H, Iyoda K. seguridad a largo plazo y resultado de las convulsiones en pacientes japoneses con síndrome de Lennox-Gastaut que reciben terapia concomitante con rufinamida: un estudio abierto tras un ensayo clínico aleatorizado. Epilepsy Res (2016) 121:1-7. doi: 10.1016 / j. eplepsyres.2016.01.002
PubMed Abstract | CrossRef Texto Completo | Google Scholar
55. Conry JA, Ng YT, Kernitsky L, Mitchell WG, Veidemanis R, Drummond R, et al., Las dosis estables de clobazam para el síndrome de Lennox-Gastaut se asocian con mejorías sostenidas de crisis por caída y crisis total durante 3 años. Epilepsia (2014) 55(4):558-67. doi: 10.1111 / epi.12561
CrossRef Texto Completo | Google Scholar
56. Munn R, Camfield P, Camfield C, Dooley J. Clobazam for refractory childhood seizure disorders – a valuable supplementary drug. Can J Neurol Sci (1988) 15(4):406-8.,
Google Scholar
60. Hussain SA, Zhou R, Jacobson C, Weng J, Cheng E, Lay J, et al. Perceived efficacy of cannabidiol-enriched cannabis extracts for treatment of pediatric epilepsy: a potential role for infantile spasms and Lennox-Gastaut syndrome. Epilepsy Behav (2015) 47:138–41. doi:10.1016/j.yebeh.2015.04.009
PubMed Abstract | CrossRef Full Text | Google Scholar
62., Geffrey al, Pollack SF, Bruno PL, Thiele EA. Interacción farmacológica entre clobazam y cannabidiol en niños con epilepsia refractaria. Epilepsia (2015) 56(8):1246-51. doi: 10.1111 / epi.13060
PubMed Abstract | CrossRef Texto Completo | Google Scholar
65. Biró a, Stephani U, Tarallo T, Bast T, Schlachter K, Fleger M, et al. Eficacia y tolerabilidad de perampanel en niños y adolescentes con epilepsias refractarias: primeras experiencias. Neuropediatría (2015) 46(2):110-6. doi: 10.,1055/s-0035-1546276
PubMed Abstract | CrossRef Texto Completo | Google Scholar
69. Lemmon ME, Terao NN, Ng YT, Reisig W, Rubenstein JE, Kossoff EH. Efficacy of the ketogenic diet in Lennox-Gastaut syndrome: a retrospective review of one institution’s experience and summary of the literature. Dev Med Child Neurolog (2012) 54(5):464-8. doi: 10.1111 / j.1469-8749.2012.04233.,x
PubMed Abstract | CrossRef Full Text | Google Scholar
72. Sharma S, Jain P, Gulati S, Sankhyan N, Agarwala A. Use of the modified Atkins diet in Lennox Gastaut syndrome. J Child Neurol (2015) 30(5):576–9. doi:10.1177/0883073814527162
PubMed Abstract | CrossRef Full Text | Google Scholar
76. Chambers A, Bowen JM. Electrical stimulation for drug-resistant epilepsy: an evidence-based analysis., Ont Health Technol Assess Ser (2013) 13(18):1-37.
PubMed Abstract | Google Scholar
77. Morris GL III, Gloss D, Buchhalter J, Mack KJ, Nickels K, Harden C. Evidence-based guideline update: vagus nerve stimulation for the treatment of epilepsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurología (2013) 81(16):1453-9. doi: 10.1212 / WNL.,0b013e3182a393d1
CrossRef Full Text | Google Scholar
78. Karceski S. Vagus nerve stimulation and Lennox-Gastaut syndrome: a review of the literature and data from the VNS patient registry. CNS Spectr (2001) 6(9):766–70. doi:10.1017/S1092852900001516
PubMed Abstract | CrossRef Full Text | Google Scholar
84. Rolston JD, Englot DJ, Wang DD, Garcia PA, Chang EF., Corpus callosotomy versus vagus nerve stimulation for atonic seizures and drop attacks: a systematic review. Epilepsy Behav (2015) 51:13–7. doi:10.1016/j.yebeh.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
86. Cukiert A, Cukiert CM, Burattini JA, Lima AM, Forster CR, Baise C, et al. Long-term outcome after callosotomy or vagus nerve stimulation in consecutive prospective cohorts of children with Lennox-Gastaut or Lennox-like syndrome and non-specific MRI findings., Convulsiones (2013) 22(5):396-400. doi: 10.1016 / j.incautación.2013.02.009
PubMed Abstract | CrossRef Texto Completo | Google Scholar
87. Kwan SY, Lin JH, Wong TT, Chang KP, Yiu CH. Comparación del desenlace de las convulsiones después de la callosotomía en pacientes con síndrome de Lennox-Gastaut y antecedentes positivos o negativos de síndrome de West. Convulsiones (2006) 15(7):552-7. doi: 10.1016 / j.incautación.2006.06.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
89. Katagiri M, Iida K, Kagawa K, Hashizume A, Ishikawa N, Hanaya R, et al. Combined surgical intervention with vagus nerve stimulation following corpus callosotomy in patients with Lennox-Gastaut syndrome. Acta Neurochir (Wien) (2016) 158(5):1005–12. doi:10.1007/s00701-016-2765-9
CrossRef Full Text | Google Scholar
93. Akman CI., Nonconvulsive status epilepticus and continuous spike and slow wave of sleep in children. Semin Pediatr Neurol (2010) 17(3):155–62. doi:10.1016/j.spen.2010.06.009
PubMed Abstract | CrossRef Full Text | Google Scholar
94. Walker M, Cross H, Smith S, Young C, Aicardi J, Appleton R, et al. Nonconvulsive status epilepticus: Epilepsy Research Foundation workshop reports. Epileptic Disord (2005) 7(3):253–96.,
PubMed Abstract | Google Scholar
98. Jurasek L, Ray L, Quigley D. Development and implementation of an adolescent epilepsy transition clinic. J Neurosci Nurs (2010) 42(4):181–9. doi:10.1097/JNN.0b013e3181e26be6
PubMed Abstract | CrossRef Full Text | Google Scholar
103. Ogawa K, Kanemoto K, Ishii Y, Koyama M, Shirasaka Y, Kawasaki J, et al., Estudio de seguimiento a largo plazo del síndrome de Lennox-Gastaut en pacientes con discapacidad motora e intelectual grave: con especial referencia al problema de la disfagia. Convulsiones (2001) 10(3):197-202. doi: 10.1053 / seiz.2000.0483
CrossRef Texto Completo | Google Scholar
105. O’Brien LM. Los efectos neurocognitivos de la interrupción del sueño en niños y adolescentes. Niño Adolesc Psychiatr Clin N Am (2009) 18(4):813-23. doi: 10.1016 / j.chc.2009.04.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
109. Arzimanoglou A, Resnick T. Diagnosing and treating epileptic drop attacks, atypical absences and episodes of nonconvulsive status epilepticus. Epileptic Disord (2011) 13(Suppl 1):S1–2. doi:10.1684/epd.2011.0408
CrossRef Full Text | Google Scholar
110. Kivity S, Lerman P, Ariel R, Danziger Y, Mimouni M, Shinnar S., Resultados cognitivos a largo plazo de una cohorte de niños con espasmos infantiles criptogénicos tratados con dosis altas de hormona adrenocorticotrópica. Epilepsia (2004) 45(3):255-62. doi: 10.1111 / j. 0013-9580.2004.30503.x
PubMed Abstract / CrossRef Full Text / Google Scholar