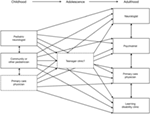
Figura 2. Schema che illustra la crescente dispersione dell’offerta di assistenza dopo il passaggio dai servizi pediatrici a quelli per adulti (3). Riprodotto con il permesso di John Libbey Eurotext.,
Altre considerazioni per la gestione del LGS
I pazienti con sindrome di Lennox–Gastaut sono compromessi nella loro vita quotidiana non solo da una varietà di tipi di crisi che sono spesso frequenti e fisicamente dannosi (come gli attacchi di caduta), ma anche da una varietà di gravi comorbidità (3). Comorbidità che sono particolarmente associati con LGS includono problemi cognitivi e comportamentali, disabilità fisica, e disturbi del sonno., Cinque anni dopo l’insorgenza di LGS, il 75-95% dei pazienti ha un deterioramento cognitivo (101, 102) e problemi comportamentali, come iperattività, aggressività e tratti autistici, si sviluppano in circa il 50% (10). La mobilità è spesso gravemente influenzata da frequenti convulsioni (in particolare attacchi di caduta), che sono fisicamente impegnative e spesso provocano lesioni (3). I pazienti devono spesso fare uso di dispositivi di protezione (come una sedia a rotelle, casco, e/o faceguard) per ridurre al minimo gli effetti fisici delle crisi epilettiche. A volte l’uso di dispositivi di protezione (ad es.,, rimanendo in una sedia a rotelle per proteggersi da lesioni da attacchi di caduta) può avere un impatto sulla mobilità dei pazienti, alimentandosi in un circolo vizioso che limita la loro capacità di essere fisicamente attivi. Inoltre, lo sviluppo precoce della disfagia è fortemente associato a una scarsa prognosi delle crisi a lungo termine (103) e influenza la capacità dei pazienti di mangiare e assumere farmaci.
I pazienti con LGS soffrono di interruzione del ciclo del sonno a causa del verificarsi di convulsioni durante la notte., La privazione del sonno e / o l’interruzione influenzano i meccanismi neurofisiologici e neurochimici importanti per il processo di apprendimento della memoria (104) e possono anche causare una vasta gamma di disturbi comportamentali, cognitivi e dell’umore, tra cui iperattività, voti scolastici ridotti e depressione (105).
Un’attenta gestione delle comorbidità in LGS è un aspetto fondamentale della cura. Alcuni AEDs possono causare o esacerbare comorbidità (ad es., disturbi cognitivi, depressione), e la scelta del trattamento AED deve quindi prendere in considerazione questa possibilità; ad esempio, le benzodiazepine utilizzate per trattare i disturbi del sonno possono precipitare convulsioni toniche in LGS (106). Occorre inoltre considerare attentamente il potenziale di interazioni farmaco–farmaco con i farmaci utilizzati per il trattamento delle comorbidità.,
A causa del notevole carico di convulsioni e comorbidità e degli effetti collaterali dei farmaci associati, la QoL dei pazienti LGS è compromessa a molti livelli (fisico, mentale, sociale) per tutta la vita (3). L’impatto fisico del LGS e le misure preventive adottate per ridurre al minimo questo impatto, influenzano gravemente la capacità dei pazienti di partecipare alle attività quotidiane e la frequenza scolastica è spesso interrotta. I problemi cognitivi e comportamentali spesso richiedono esigenze educative e di cura specifiche che impediranno la frequenza scolastica tradizionale (3)., Inoltre, il suddetto impatto delle crisi notturne sul sonno può compromettere direttamente la QoL dei pazienti (107). Gli effetti del LGS sull’indipendenza, la capacità di lavorare, la partecipazione sociale e le relazioni personali continuano a compromettere gravemente la QoL dei pazienti nell’età adulta (3).,jor impatto sulla QoL dei genitori/accompagnatori e famiglie a causa della limitazione della vita sociale e problemi di relazione tra i partner e gli altri membri della famiglia; sentimenti di isolamento, che può portare a depressione; problemi con l’assistenza dei bambini, che possono limitare ulteriormente la partecipazione sociale e le opportunità per una pausa; la stanchezza fisica e/o sonno interrotto; l’ansia per quando convulsioni si verificano, le prospettive future dell’individuo, LGS, e lo stigma sociale associato con la condizione; così come le difficoltà finanziarie derivanti dalla rinuncia di sviluppo di carriera in favore di caregiving (108).,
Poiché il LGS costituisce un onere importante per i pazienti e i loro caregiver / famiglie, è necessario un approccio multidisciplinare e individualizzato all’assistenza, che soddisfi le esigenze mediche, educative, psicologiche e sociali di ciascun paziente nel corso della sua vita (109). Le esigenze del paziente e del suo caregiver/famiglia dovrebbero idealmente essere rivalutate annualmente, tenendo conto di fattori come la salute fisica del paziente, il loro potenziale bisogno di istituzionalizzazione (in particolare nell’età adulta) e il supporto per il caregiver/famiglia.,
Aree per la ricerca futura
Attualmente, gli AED sono farmaci anti-sequestro e quindi trattano i sintomi dell’epilessia piuttosto che le sue cause. La ricerca futura dovrebbe concentrarsi sul chiarire la storia naturale del LGS e se un trattamento appropriato possa avere un impatto benefico sul decorso della malattia. Questo non dovrebbe includere solo gli effetti del trattamento farmacologico, ma anche il ruolo delle procedure chirurgiche come la callosotomia., È stato suggerito che il controllo precoce delle crisi epilettiche in LGS sia associato a risultati neurocognitivi migliorati (2), ma la rilevanza di ciò in LGS de novo, così come l’impatto della soppressione delle crisi nei bambini più grandi e negli adulti, è meno certa ed è un’area che merita uno studio più approfondito. Sebbene attualmente venga prestata attenzione ai potenziali effetti dannosi degli AEDS sulla cognizione, è necessaria una ricerca per chiarire se altri trattamenti non-AED possano proteggere dal deterioramento cognitivo e/o migliorare la cognizione nei pazienti con LGS., Inoltre, la ricerca è necessaria per sviluppare strumenti standardizzati per gli assistenti per misurare regolarmente i cambiamenti nelle prestazioni cognitive e nel comportamento dei pazienti nel tempo. È inoltre necessario chiarire se esistono genotipi specifici o mutazioni genetiche che determinano una suscettibilità al LGS, che potrebbe indirizzare lo sviluppo di strumenti diagnostici.
Dati i problemi associati al conteggio delle crisi in LGS (a causa della frequenza degli attacchi di caduta, della lunghezza delle crisi di assenza, ecc.,), il valore predittivo dell’uso di endpoint alternativi nella ricerca sugli studi clinici dovrebbe essere valutato, come il numero di giorni senza crisi, piuttosto che la frequenza delle crisi di per sé. La caratterizzazione dei fattori che predicono la risposta al trattamento nei pazienti LGS sarebbe anche preziosa nelle impostazioni di ricerca e pratica clinica. Altre potenziali aree di ricerca future includono la rilevanza della terapia steroidea in LGS, e se può migliorare la cognizione, e gli effetti a lungo termine del trattamento con cannabidiolo in LGS, in termini di AEs e il potenziale sviluppo della tolleranza.,
Autore Contributi
Tutti gli autori (JC, SA, MF, PS, AA e AA) ha fornito un contributo sostanziale alla concezione di questo articolo e l’analisi e l’interpretazione dei dati in essa contenuti; sono stati coinvolti nella stesura di un articolo o una revisione critica, con un importante contenuto intellettuale, a condizione dell’approvazione finale della versione da pubblicare; e accettato di essere responsabile per tutti gli aspetti del lavoro nel garantire che le questioni relative all’accuratezza o l’integrità di qualsiasi parte del lavoro sono stati opportunamente studiati e risolti.,
Dichiarazione di conflitto di interessi
JC ha fatto parte di comitati consultivi per Eisai, UCB, Shire, Zogenix, Vitaflo e Nutricia, per i quali sono stati pagati pagamenti e onorari al suo dipartimento. Ha partecipato come investigatore per Vitaflo, GW Pharmaceuticals e Zogenix, con fondi versati al suo dipartimento. Ha anche ricevuto fondi di ricerca da Vitaflo. È supportata dal National Institute for Health Research Biomedical Research Centre presso il Great Ormond Street Hospital for Children NHS Foundation Trust e University College London., SA ha fatto parte di comitati consultivi per Eisai, GSK, Novartis, Nutricia, Shire, Ultragenyx e Zogenix. Ha partecipato come investigatore per Advenne Pharma, Eisai, UCB, Ultragenyx e Zogenix, con fondi versati al suo ospedale o al suo laboratorio di ricerca. MF ha partecipato come investigatore per UCB, GW Pharmaceuticals, Pfizer e LivaNova, con fondi versati al suo dipartimento. Ha ricevuto fondi di ricerca da Eisai, UCB, LivaNova ed Esteve, con fondi versati al suo dipartimento. Ha ricevuto speaker honoraria da Eisai, UCB, LivaNova, Bial ed Esteve., PS ha ricevuto onorari da FB Health, Kolfarma s. r.l., UCB Pharma e Eisai Inc., e il sostegno alla ricerca del Ministero della Salute e della Fondazione Telethon. AA ha ricevuto borse di ricerca dalla Commissione europea, UCB Pharma e CaixaBank, con fondi versati al suo dipartimento e commissioni di consulenza da Eisai, GW, Shire, Takeda, Zogenix e UCB Pharma.
Riconoscimenti
Il supporto editoriale per la preparazione di questo manoscritto è stato fornito da John Scopes di MXM Medical Communications.,
Finanziamento
La riunione del consensus group per lo sviluppo di questa pubblicazione è stata organizzata e finanziata da Eisai Ltd. Il supporto editoriale per la preparazione di questa pubblicazione è stato finanziato da Eisai Ltd. Le opinioni espresse in questo articolo sono le opinioni di consenso indipendenti degli autori e non sono state influenzate da sponsorizzazioni di terze parti.
Abbreviazioni
Note a piè di pagina
2. Arzimanoglou A, Resnick T. Tutti i bambini che soffrono di cadute epilettiche non hanno necessariamente la sindrome di Lennox-Gastaut… ma molti lo fanno., Epileptic Disord (2011) 13(Suppl 1):S3–13. doi:10.1684/epd.2011.0422
CrossRef Full Text | Google Scholar
3. Kerr M, Kluger G, Philip S. Evolution and management of Lennox-Gastaut syndrome through adolescence and into adulthood: are seizures always the primary issue? Epileptic Disord (2011) 13(Suppl 1):S15–26. doi:10.1684/epd.2011.0409
PubMed Abstract | CrossRef Full Text | Google Scholar
5., Goldsmith IL, Zupanc ML, Buchhalter JR. Long-term seizure outcome in 74 patients with Lennox-Gastaut syndrome: effects of incorporating MRI head imaging in defining the cryptogenic subgroup. Epilepsia (2000) 41(4):395–9. doi:10.1111/j.1528-1157.2000.tb00179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes., Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia (1989) 30(4):389–99. doi:10.1111/j.1528-1157.1989.tb05316.x
CrossRef Full Text | Google Scholar
10. van Rijckevorsel K. Treatment of Lennox-Gastaut syndrome: overview and recent findings. Neuropsychiatr Dis Treat (2008) 4(6):1001–19. doi:10.2147/NDT.,S1668
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gastaut H, Dravet C, Loubier D. Evolution clinique et prognostic du syndrome de Lennox-Gastaut. In: Lugaresi E, Pazzaglia P, Tassinari CA, editors. Evolution and Prognosis of Epilepsies. Bologna, Italy: Aulo Gaggi (1973). p. 133–54.
Google Scholar
17. EuroEPINOMICS-RES Consortium, Epilepsy Phenome/Genome Project, Epi4K Consortium., De novo mutations in synaptic transmission genes including DNM1 cause epileptic encephalopathies. Am J Hum Genet (2014) 95(4):360–70. doi:10.1016/j.ajhg.2014.08.013
CrossRef Full Text | Google Scholar
18. Epilepsy Phenome/Genome Project Epi4K Consortium. Copy number variant analysis from exome data in 349 patients with epileptic encephalopathy. Ann Neurol (2015) 78(2):323–8. doi:10.1002/ana.,24457
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Larsen J, Johannesen KM, Ek J, Tang S, Marini C, Blichfeldt S, et al. The role of SLC2A1 mutations in myoclonic astatic epilepsy and absence epilepsy, and the estimated frequency of GLUT1 deficiency syndrome. Epilepsia (2015) 56(12):e203–8. doi:10.1111/epi.13222
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Hughes JR, Patil VK., Long-term electro-clinical changes in the Lennox-Gastaut syndrome before, during, and after the slow spike-wave pattern. Clin Electroencephalogr (2002) 33(1):1–7. doi:10.1177/155005940203300103
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Doose H. Myoclonic-astatic epilepsy. Epilepsy Res Suppl (1992) 6:163–8.
PubMed Abstract | Google Scholar
26. Patry G, Lyagoubi S, Tassinari CA., Subclinical “electrical status epilepticus” induced by sleep in children. A clinical and electroencephalographic study of six cases. Arch Neurol (1971) 24(3):242–52. doi:10.1001/archneur.1971.00480330070006
CrossRef Full Text | Google Scholar
28. King DW, Smith JR. Supplementary sensorimotor area epilepsy in adults. Adv Neurol (1996) 70:285–91.
PubMed Abstract | Google Scholar
29., Khan SA, Carney PW, Archer JS. Breve postura tonica asimmetrica con attività rapida diffusa a bassa tensione nelle convulsioni derivanti dalla regione parietale mesiale. Epilessia Res (2014) 108(10):1950-4. doi: 10.1016 / j. eplepsyres.2014.09.011
PubMed Abstract | CrossRef Full Text/Google Scholar
33. Sindrome di Ohtahara S. Lennox-Gastaut. Considerazioni nel suo concetto e categorizzazione. Jpn J Psichiatria Neurolo (1988) 42(3):535-42.,
PubMed Abstract | Google Scholar
35. Pujar S, Calvert S, Cortina-Borja M, Chin RF, Smith RA, Cross JH, et al. Statistical process control (SPC) – a simple objective method for monitoring seizure frequency and evaluating effectiveness of drug interventions in refractory childhood epilepsy. Epilepsy Res (2010) 91(2–3):205–13. doi:10.1016/j.eplepsyres.2010.07.013
CrossRef Full Text | Google Scholar
39., Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry (2006) 77(2):193–8. doi:10.1136/jnnp.2005.074203
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Motte J, Trevathan E, Arvidsson JF, Barrera MN, Mullens EL, Manasco P, et al. Lamotrigine for generalized seizures associated with the Lennox-Gastaut syndrome., N Engl J Med (1997) 337(25):1807–12. doi:10.1056/NEJM199712183372504
CrossRef Full Text | Google Scholar
46. The Felbamate Study Group in Lennox-Gastaut Syndrome. Efficacy of felbamate in childhood epileptic encephalopathy (Lennox-Gastaut syndrome). N Engl J Med (1993) 328(1):29–33. doi:10.1056/NEJM199301073280105
CrossRef Full Text | Google Scholar
52., Ohtsuka Y, Yoshinaga H, Shirasaka Y, Takayama R, Takano H, Iyoda K. Sicurezza a lungo termine ed esito convulsivo in pazienti giapponesi con sindrome di Lennox-Gastaut sottoposti a terapia aggiuntiva con rufinamide: uno studio in aperto a seguito di uno studio clinico randomizzato. Epilessia Res (2016) 121:1-7. doi: 10.1016 / j. eplepsyres.2016.01.002
PubMed Abstract | CrossRef Full Text/Google Scholar
55. Conry JA, Ng YT, Kernitsky L, Mitchell WG, Veidemanis R, Drummond R, et al., I dosaggi stabili di clobazam per la sindrome di Lennox-Gastaut sono associati con i miglioramenti sostenuti di caduta-sequestro e totale-sequestro in 3 anni. Epilepsia (2014) 55(4):558-67. doi: 10.1111 / epi.12561
CrossRef Full Text/Google Scholar
56. Munn R, Camfield P, Camfield C, Dooley J. Clobazam per i disturbi refrattari delle crisi infantili-un prezioso farmaco supplementare. Può J Neurol Sci (1988) 15(4):406-8.,
Google Scholar
60. Hussain SA, Zhou R, Jacobson C, Weng J, Cheng E, Lay J, et al. Perceived efficacy of cannabidiol-enriched cannabis extracts for treatment of pediatric epilepsy: a potential role for infantile spasms and Lennox-Gastaut syndrome. Epilepsy Behav (2015) 47:138–41. doi:10.1016/j.yebeh.2015.04.009
PubMed Abstract | CrossRef Full Text | Google Scholar
62., Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Interazione farmaco-farmaco tra clobazam e cannabidiolo nei bambini con epilessia refrattaria. Epilepsia (2015) 56(8):1246-51. doi: 10.1111 / epi.13060
PubMed Abstract | CrossRef Full Text/Google Scholar
65. Biró A, Stephani U, Tarallo T, Bast T, Schlachter K, Fleger M, et al. Efficacia e tollerabilità di perampanel in bambini e adolescenti con epilessie refrattarie: prime esperienze. Neuropediatrics (2015) 46(2):110-6. doi: 10.,1055/s-0035-1546276
PubMed Abstract | CrossRef Full Text/Google Scholar
69. Lemmon ME, Terao NN, Ng YT, Reisig W, Rubenstein JE, Kossoff EH. Efficacia della dieta chetogenica nella sindrome di Lennox-Gastaut: una revisione retrospettiva dell’esperienza di un’istituzione e una sintesi della letteratura. Dev Med Neurolo infantile (2012) 54(5):464-8. doi:10.1111 / j. 1469-8749. 2012.04233.,x
PubMed Abstract | CrossRef Full Text | Google Scholar
72. Sharma S, Jain P, Gulati S, Sankhyan N, Agarwala A. Use of the modified Atkins diet in Lennox Gastaut syndrome. J Child Neurol (2015) 30(5):576–9. doi:10.1177/0883073814527162
PubMed Abstract | CrossRef Full Text | Google Scholar
76. Chambers A, Bowen JM. Electrical stimulation for drug-resistant epilepsy: an evidence-based analysis., Ont Salute Technol Valutare Ser (2013) 13(18):1-37.
PubMed Abstract/Google Scholar
77. Morris GL III, Gloss D, Buchhalter J, Mack KJ, Nickels K, Harden C. Aggiornamento delle linee guida basate sull’evidenza: stimolazione del nervo vago per il trattamento dell’epilessia: relazione della sottocommissione per lo sviluppo delle linee guida dell’American Academy of Neurology. Neurologia (2013) 81(16):1453-9. doi: 10.1212 / WNL.,0b013e3182a393d1
CrossRef Full Text | Google Scholar
78. Karceski S. Vagus nerve stimulation and Lennox-Gastaut syndrome: a review of the literature and data from the VNS patient registry. CNS Spectr (2001) 6(9):766–70. doi:10.1017/S1092852900001516
PubMed Abstract | CrossRef Full Text | Google Scholar
84. Rolston JD, Englot DJ, Wang DD, Garcia PA, Chang EF., Corpus callosotomy versus vagus nerve stimulation for atonic seizures and drop attacks: a systematic review. Epilepsy Behav (2015) 51:13–7. doi:10.1016/j.yebeh.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
86. Cukiert A, Cukiert CM, Burattini JA, Lima AM, Forster CR, Baise C, et al. Long-term outcome after callosotomy or vagus nerve stimulation in consecutive prospective cohorts of children with Lennox-Gastaut or Lennox-like syndrome and non-specific MRI findings., Sequestro (2013) 22(5):396-400. doi:10.1016 / j.sequestro.2013.02.009
PubMed Abstract | CrossRef Full Text/Google Scholar
87. Kang KP, Lin JH, Wong TT, Chang KP, Yiu CH. Un confronto tra l’esito del sequestro dopo callosotomia in pazienti con sindrome di Lennox-Gastaut e una storia positiva o negativa per la sindrome di West. Sequestro (2006) 15(7):552-7. doi:10.1016 / j.sequestro.2006.06.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
89. Katagiri M, Iida K, Kagawa K, Hashizume A, Ishikawa N, Hanaya R, et al. Combined surgical intervention with vagus nerve stimulation following corpus callosotomy in patients with Lennox-Gastaut syndrome. Acta Neurochir (Wien) (2016) 158(5):1005–12. doi:10.1007/s00701-016-2765-9
CrossRef Full Text | Google Scholar
93. Akman CI., Nonconvulsive status epilepticus and continuous spike and slow wave of sleep in children. Semin Pediatr Neurol (2010) 17(3):155–62. doi:10.1016/j.spen.2010.06.009
PubMed Abstract | CrossRef Full Text | Google Scholar
94. Walker M, Cross H, Smith S, Young C, Aicardi J, Appleton R, et al. Nonconvulsive status epilepticus: Epilepsy Research Foundation workshop reports. Epileptic Disord (2005) 7(3):253–96.,
PubMed Abstract | Google Scholar
98. Jurasek L, Ray L, Quigley D. Development and implementation of an adolescent epilepsy transition clinic. J Neurosci Nurs (2010) 42(4):181–9. doi:10.1097/JNN.0b013e3181e26be6
PubMed Abstract | CrossRef Full Text | Google Scholar
103. Ogawa K, Kanemoto K, Ishii Y, Koyama M, Shirasaka Y, Kawasaki J, et al., Studio di follow – up a lungo termine della sindrome di Lennox-Gastaut in pazienti con gravi disabilità motorie e intellettive: con particolare riferimento al problema della disfagia. Sequestro (2001) 10(3):197-202. doi:10.1053 / seiz.2000.0483
CrossRef Full Text/Google Scholar
105. O’Brien LM. Gli effetti neurocognitivi dell’interruzione del sonno nei bambini e negli adolescenti. Bambino Adulesc Psychiatr Clin N Am (2009) 18(4):813-23. doi: 10.1016 / j.chc.2009.04.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
109. Arzimanoglou A, Resnick T. Diagnosing and treating epileptic drop attacks, atypical absences and episodes of nonconvulsive status epilepticus. Epileptic Disord (2011) 13(Suppl 1):S1–2. doi:10.1684/epd.2011.0408
CrossRef Full Text | Google Scholar
110. Kivity S, Lerman P, Ariel R, Danziger Y, Mimouni M, Shinnar S., Risultati cognitivi a lungo termine di una coorte di bambini con spasmi infantili criptogenetici trattati con ormone adrenocorticotropo ad alte dosi. Epilepsia (2004) 45(3):255-62. doi: 10.1111 / j.0013-9580. 2004.30503.x
PubMed Abstract | CrossRef Full Text / Google Scholar