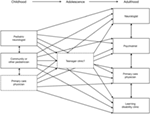
Rysunek 2. Schemat ilustrujący rosnącą dyspersję świadczenia opieki po przejściu z usług pediatrycznych na usługi dla dorosłych (3). Reprodukcja za zgodą John Libbey Eurotext.,
inne uwagi dotyczące leczenia LGS
pacjenci z zespołem Lennoxa–Gastauta są upośledzeni w codziennym życiu nie tylko przez różne rodzaje napadów, które są często częste i szkodliwe fizycznie (takie jak ataki upuszczania), ale także przez różne poważne choroby współistniejące (3). Choroby współistniejące, które są szczególnie związane z LGS obejmują problemy poznawcze i behawioralne, niepełnosprawność fizyczną i zaburzenia snu., Pięć lat po wystąpieniu LGS 75-95% pacjentów ma zaburzenia poznawcze (101, 102), a problemy behawioralne, takie jak nadpobudliwość, agresywność i cechy autystyczne, rozwijają się u około 50% (10). Na mobilność często mają duży wpływ częste napady padaczkowe (szczególnie ataki upuszczania), które są wymagające fizycznie i często powodują obrażenia (3). Pacjenci często muszą korzystać z wyposażenia ochronnego (takiego jak wózek inwalidzki, kask, i/lub faceguard), aby zminimalizować fizyczne skutki napadów. Czasami stosowanie sprzętu ochronnego (np.,, pozostawanie na wózku inwalidzkim w celu ochrony przed obrażeniami od ataków upuszczania) może samo w sobie wpływać na mobilność pacjentów, wprowadzając ich w błędne koło, które ogranicza ich zdolność do aktywności fizycznej. Ponadto wczesny rozwój dysfagii jest silnie związany ze słabym długoterminowym rokowaniem napadów padaczkowych (103) i wpływa na zdolność pacjentów do jedzenia i przyjmowania leków.
pacjenci z LGS cierpią na zaburzenia cyklu snu z powodu występowania napadów w nocy., Brak snu i / lub zakłócenia wpływają na mechanizmy neurofizjologiczne i neurochemiczne ważne dla procesu uczenia się pamięci (104), a także mogą prowadzić do szerokiego zakresu zaburzeń zachowania, poznawczych i nastroju, w tym nadpobudliwości, obniżonych ocen szkolnych i depresji (105).
staranne zarządzanie chorobami współistniejącymi w LGS jest podstawowym aspektem opieki. Niektóre leki przeciwpadaczkowe mogą powodować lub nasilać choroby współistniejące (np.,, zaburzenia poznawcze, depresja), a wybór leczenia AED musi zatem uwzględniać tę możliwość; na przykład benzodiazepiny stosowane w leczeniu zaburzeń snu mogą powodować napady toniczne w LGS (106). Należy również zwrócić szczególną uwagę na możliwość interakcji leków AED z lekami stosowanymi w leczeniu chorób współistniejących.,
w wyniku znacznego obciążenia drgawkami i chorobami współistniejącymi oraz skutków ubocznych związanych z nimi leków, QoL pacjentów z LGS jest osłabiony na wielu poziomach (fizycznym, psychicznym, społecznym) przez całe życie (3). Fizyczny wpływ LGS i środki zapobiegawcze podjęte w celu zminimalizowania tego wpływu poważnie wpływają na zdolność pacjentów do uczestniczenia w codziennych czynnościach, a frekwencja w szkole jest często zakłócana. Problemy poznawcze i behawioralne często wymagają szczególnych potrzeb edukacyjnych i opiekuńczych, które uniemożliwiają uczęszczanie do szkoły (3)., Ponadto wspomniany wpływ napadów nocnych na sen może bezpośrednio upośledzać QoL pacjentów (107). Wpływ LGS na niezależność, zdolność do pracy, uczestnictwo społeczne i relacje osobiste nadal poważnie upośledza QoL pacjentów w dorosłym życiu (3).,wpływ jor na QoL rodziców / opiekunów i rodzin z powodu ograniczenia życia społecznego i problemów związanych z relacjami między partnerami i innymi członkami rodziny; poczucie izolacji, które może prowadzić do depresji; problemy z opieką nad dziećmi, które mogą dodatkowo ograniczać uczestnictwo społeczne i możliwości wytchnienia; wyczerpanie fizyczne i / lub zakłócenie snu; niepokój o to, kiedy wystąpią napady padaczkowe, przyszłe perspektywy jednostki z LGS i społeczne piętno związane z tym stanem; jak również trudności finansowe wynikające z rezygnacji z rozwoju kariery na rzecz opieki (108).,
ponieważ LGS stanowi duże obciążenie dla pacjentów i ich opiekunów / rodzin, wymagane jest multidyscyplinarne, zindywidualizowane podejście do opieki, które zaspokaja potrzeby medyczne, edukacyjne, psychologiczne i społeczne każdego pacjenta przez cały okres ich życia (109). Potrzeby pacjenta i jego opiekuna/rodziny powinny być poddawane corocznej ponownej ocenie, biorąc pod uwagę takie czynniki, jak zdrowie fizyczne pacjenta, potencjalne zapotrzebowanie na instytucjonalizację (szczególnie w dorosłym życiu) oraz wsparcie dla opiekuna/rodziny.,
obszary przyszłych badań
obecnie leki przeciwpadaczkowe są lekami przeciwpadaczkowymi i dlatego leczą objawy padaczki, a nie jej przyczyny. Przyszłe badania powinny koncentrować się na wyjaśnieniu Historii Naturalnej LGS i czy odpowiednie leczenie może mieć korzystny wpływ na przebieg choroby. Powinno to obejmować nie tylko efekty leczenia farmakologicznego, ale także rolę zabiegów chirurgicznych, takich jak callosotomia., Sugeruje się, że wczesna Kontrola napadów w LGS wiąże się z poprawą wyników neurokognitywnych (2), ale znaczenie tego w de novo LGS, jak również wpływ tłumienia napadów u starszych dzieci i dorosłych, jest mniej pewne i jest obszarem, który wymaga bliższych badań. Chociaż obecnie zwraca się uwagę na potencjalny szkodliwy wpływ AED na poznanie, badania są wymagane w celu wyjaśnienia, czy inne zabiegi bez AED mogą chronić przed zaburzeniami poznawczymi i / lub poprawić poznanie u pacjentów z LGS., Ponadto potrzebne są badania w celu opracowania standardowych narzędzi dla opiekunów, aby rutynowo mierzyć zmiany w wydajności poznawczej i zachowaniu pacjentów w czasie. Konieczne jest również wyjaśnienie, czy istnieją specyficzne genotypy lub mutacje genetyczne, które determinują podatność na LGS, co mogłoby ukierunkować rozwój narzędzi diagnostycznych.
biorąc pod uwagę problemy związane z zliczaniem napadów w LGS (ze względu na częstotliwość ataków upuszczania, długość napadów nieobecności itp.,), należy ocenić predykcyjną wartość wykorzystania alternatywnych punktów końcowych w badaniach klinicznych, takich jak liczba dni wolnych od napadów, a nie częstotliwość napadów per se. Charakterystyka czynników przewidujących odpowiedź na leczenie u pacjentów z LGS byłaby również cenna w badaniach i praktyce klinicznej. Inne potencjalne obszary przyszłych badań obejmują znaczenie terapii steroidowej w LGS i czy może ona poprawić poznanie oraz długoterminowe efekty leczenia kanabidiolem w LGS, pod względem AEs i potencjalnego rozwoju tolerancji.,
wkład autora
wszyscy autorzy (JC, SA, MF, PS i AA) wnieśli znaczący wkład w koncepcję tego artykułu oraz analizę i interpretację zawartych w nim danych; byli zaangażowani w opracowanie artykułu lub jego krytyczną korektę pod kątem ważnych treści intelektualnych; pod warunkiem ostatecznego zatwierdzenia wersji, która ma zostać opublikowana; i zgodzili się być odpowiedzialni za wszystkie aspekty pracy w zapewnieniu, że kwestie związane z dokładnością lub integralnością jakiejkolwiek części pracy zostały odpowiednio zbadane i rozwiązane.,
JC zasiadała w radach doradczych Eisai, UCB, Shire, Zogenix, Vitaflo i Nutricia, za które wypłacono jej działowi wynagrodzenie i honoraria. Brała udział jako badaczka dla Vitaflo, GW Pharmaceuticals i Zogenix, z funduszami wypłacanymi jej działowi. Otrzymała również fundusze na badania od Vitaflo. Jest wspierana przez National Institute for Health Research Biomedical Research Centre przy Great Ormond Street Hospital for Children NHS Foundation Trust i University College London., SA zasiadał w radach doradczych Eisai, GSK, Novartis, Nutricia, Shire, Ultragenyx i Zogenix. Brał udział jako badacz dla Advicenne Pharma, Eisai, UCB, Ultragenyx i Zogenix, z funduszy wypłacanych na jego szpital lub jego laboratorium badawcze. MF uczestniczyła jako badaczka dla UCB, GW Pharmaceuticals, Pfizer i LivaNova, z funduszami wypłaconymi jej Departamentowi. Otrzymała fundusze na badania od Eisai, UCB, Livanovy i Esteve, z funduszy wypłaconych jej Departamentowi. Otrzymała honoraria od Eisai, UCB, LivaNova, Biala i Esteve., PS otrzymał honoraria od FB Health, Kolfarma s. R.l., UCB Pharma i Eisai Inc., oraz wsparcie badawcze ze strony włoskiego Ministerstwa Zdrowia i Fundacji Telethon. AA otrzymał granty badawcze od Komisji Europejskiej, UCB Pharma i CaixaBank, z funduszy wypłaconych na jego dział, A opłaty konsultingowe od Eisai, GW, Shire, Takeda, Zogenix i UCB Pharma.
podziękowania
Wsparcie redakcyjne w przygotowaniu tego manuskryptu zapewnił John Scopes z MXM Medical Communications.,
finansowanie
spotkanie grupy konsensusowej w sprawie opracowania niniejszej publikacji zostało zorganizowane i sfinansowane przez Eisai Ltd. Wsparcie redakcyjne przy przygotowaniu tej publikacji zostało sfinansowane przez Eisai Ltd. Opinie wyrażone w tym artykule są niezależnymi konsensusowymi poglądami autorów i nie miały wpływu na sponsorowanie przez osoby trzecie.
skróty
Przypisy
2. Arzimanoglou A, Resnick T. wszystkie dzieci, które doświadczają padaczki, niekoniecznie mają zespół Lennoxa-Gastauta… ale wiele tak., Epileptic Disord (2011) 13(Suppl 1):S3–13. doi:10.1684/epd.2011.0422
CrossRef Full Text | Google Scholar
3. Kerr M, Kluger G, Philip S. Evolution and management of Lennox-Gastaut syndrome through adolescence and into adulthood: are seizures always the primary issue? Epileptic Disord (2011) 13(Suppl 1):S15–26. doi:10.1684/epd.2011.0409
PubMed Abstract | CrossRef Full Text | Google Scholar
5., Goldsmith IL, Zupanc ML, Buchhalter JR. Long-term seizure outcome in 74 patients with Lennox-Gastaut syndrome: effects of incorporating MRI head imaging in defining the cryptogenic subgroup. Epilepsia (2000) 41(4):395–9. doi:10.1111/j.1528-1157.2000.tb00179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes., Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia (1989) 30(4):389–99. doi:10.1111/j.1528-1157.1989.tb05316.x
CrossRef Full Text | Google Scholar
10. van Rijckevorsel K. Treatment of Lennox-Gastaut syndrome: overview and recent findings. Neuropsychiatr Dis Treat (2008) 4(6):1001–19. doi:10.2147/NDT.,S1668
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gastaut H, Dravet C, Loubier D. Evolution clinique et prognostic du syndrome de Lennox-Gastaut. In: Lugaresi E, Pazzaglia P, Tassinari CA, editors. Evolution and Prognosis of Epilepsies. Bologna, Italy: Aulo Gaggi (1973). p. 133–54.
Google Scholar
17. EuroEPINOMICS-RES Consortium, Epilepsy Phenome/Genome Project, Epi4K Consortium., De novo mutations in synaptic transmission genes including DNM1 cause epileptic encephalopathies. Am J Hum Genet (2014) 95(4):360–70. doi:10.1016/j.ajhg.2014.08.013
CrossRef Full Text | Google Scholar
18. Epilepsy Phenome/Genome Project Epi4K Consortium. Copy number variant analysis from exome data in 349 patients with epileptic encephalopathy. Ann Neurol (2015) 78(2):323–8. doi:10.1002/ana.,24457
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Larsen J, Johannesen KM, Ek J, Tang S, Marini C, Blichfeldt S, et al. The role of SLC2A1 mutations in myoclonic astatic epilepsy and absence epilepsy, and the estimated frequency of GLUT1 deficiency syndrome. Epilepsia (2015) 56(12):e203–8. doi:10.1111/epi.13222
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Hughes JR, Patil VK., Long-term electro-clinical changes in the Lennox-Gastaut syndrome before, during, and after the slow spike-wave pattern. Clin Electroencephalogr (2002) 33(1):1–7. doi:10.1177/155005940203300103
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Doose H. Myoclonic-astatic epilepsy. Epilepsy Res Suppl (1992) 6:163–8.
PubMed Abstract | Google Scholar
26. Patry G, Lyagoubi S, Tassinari CA., Subclinical „electrical status epilepticus” induced by sleep in children. A clinical and electroencephalographic study of six cases. Arch Neurol (1971) 24(3):242–52. doi:10.1001/archneur.1971.00480330070006
CrossRef Full Text | Google Scholar
28. King DW, Smith JR. Supplementary sensorimotor area epilepsy in adults. Adv Neurol (1996) 70:285–91.
PubMed Abstract | Google Scholar
29., Khan SA, Carney PW, Archer JS. Krótkie asymetryczne pozowanie toniczne z rozproszoną, niskonapięciową, szybką aktywnością w napadach padaczkowych powstałych w okolicy śródmiąższowej ciemieniowej. Padaczka Res (2014) 108(10):1950-4.
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zespół Ohtahara S. Lennoxa-Gastauta. Rozważania w jego koncepcji i kategoryzacji. Jpn JPN Neurol (1988) 42(3):535-42.,
PubMed Abstract | Google Scholar
35. Pujar S, Calvert S, Cortina-Borja M, Chin RF, Smith RA, Cross JH, et al. Statistical process control (SPC) – a simple objective method for monitoring seizure frequency and evaluating effectiveness of drug interventions in refractory childhood epilepsy. Epilepsy Res (2010) 91(2–3):205–13. doi:10.1016/j.eplepsyres.2010.07.013
CrossRef Full Text | Google Scholar
39., Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry (2006) 77(2):193–8. doi:10.1136/jnnp.2005.074203
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Motte J, Trevathan E, Arvidsson JF, Barrera MN, Mullens EL, Manasco P, et al. Lamotrigine for generalized seizures associated with the Lennox-Gastaut syndrome., N Engl J Med (1997) 337(25):1807–12. doi:10.1056/NEJM199712183372504
CrossRef Full Text | Google Scholar
46. The Felbamate Study Group in Lennox-Gastaut Syndrome. Efficacy of felbamate in childhood epileptic encephalopathy (Lennox-Gastaut syndrome). N Engl J Med (1993) 328(1):29–33. doi:10.1056/NEJM199301073280105
CrossRef Full Text | Google Scholar
52., Ohtsuka Y, Yoshinaga H, Shirasaka Y, Takayama R, Takano H, Iyoda K. długotrwałe bezpieczeństwo i napady padaczkowe u pacjentów Japońskich z zespołem Lennoxa-Gastauta otrzymujących leczenie wspomagające rufinamidem: badanie otwarte po randomizowanym badaniu klinicznym. Epilepsja Res (2016) 121:1-7.
PubMed Abstract | CrossRef Full Text | Google Scholar
55. Conry JA, Ng YT, Kernitsky L, Mitchell WG, Veidemanis R, Drummond R, et al., Stabilne dawki klobazamu w zespole Lennoxa-Gastauta są związane z trwałą poprawą napadów padaczkowych i napadów całkowitych w ciągu 3 lat. Epilepsja (2014) 55(4):558-67. podoba mi się! do obserwowanych nr:1011112561
CrossRef Full Text | Google Scholar
56. Munn R, Camfield P, Camfield C, Dooley J. Clobazam dla opornych zaburzeń napadów dziecięcych-cennego leku uzupełniającego. Can J Neurol Sci (1988) 15(4):406-8.,
Google Scholar
60. Hussain SA, Zhou R, Jacobson C, Weng J, Cheng E, Lay J, et al. Perceived efficacy of cannabidiol-enriched cannabis extracts for treatment of pediatric epilepsy: a potential role for infantile spasms and Lennox-Gastaut syndrome. Epilepsy Behav (2015) 47:138–41. doi:10.1016/j.yebeh.2015.04.009
PubMed Abstract | CrossRef Full Text | Google Scholar
62., Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Interakcje lek-lek pomiędzy klobazamem i kanabidiolem u dzieci z oporną na leczenie padaczką. Epilepsja (2015) 56(8):1246-51. podoba mi się! do obserwowanych nr:1011113060
PubMed Abstract | CrossRef Full Text | Google Scholar
65. Biró A, Stephani U, Tarallo T, Bast T, Schlachter K, Fleger m, et al. Skuteczność i tolerancja perampanelu u dzieci i młodzieży z oporną na leczenie padaczką: pierwsze doświadczenia. Neuropediatria (2015) 46(2):110-6. doi: 10.,1055/s-0035-1546276
PubMed Abstract | CrossRef Full Text/Google Scholar
69. Lemmon ME, Terao NN, Ng YT, Reisig w, Rubenstein JE, Kossoff EH. Skuteczność diety ketogenicznej w zespole Lennoxa-Gastauta: retrospektywny przegląd doświadczeń jednej z instytucji i podsumowanie literatury. Dev Med Child Neurol (2012) 54(5):464-8. doi:10.1111 / j. 1469-8749. 2012. 04233.,x
PubMed Abstract | CrossRef Full Text | Google Scholar
72. Sharma S, Jain P, Gulati S, Sankhyan N, Agarwala A. Use of the modified Atkins diet in Lennox Gastaut syndrome. J Child Neurol (2015) 30(5):576–9. doi:10.1177/0883073814527162
PubMed Abstract | CrossRef Full Text | Google Scholar
76. Chambers A, Bowen JM. Electrical stimulation for drug-resistant epilepsy: an evidence-based analysis., Ont Health Technoline Ser (2013) 13(18):1-37.
PubMed Abstract/Google Scholar
77. Morris GL III, Gloss D, Buchhalter J, Mack KJ, Nickels K, Harden C. evidence-based guideline update: vagus nerve stimulation for the treatment of epilepsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurologia (2013) 81(16):1453-9. podoba mi się! do obserwowanych nr:101212,0b013e3182a393d1
CrossRef Full Text | Google Scholar
78. Karceski S. Vagus nerve stimulation and Lennox-Gastaut syndrome: a review of the literature and data from the VNS patient registry. CNS Spectr (2001) 6(9):766–70. doi:10.1017/S1092852900001516
PubMed Abstract | CrossRef Full Text | Google Scholar
84. Rolston JD, Englot DJ, Wang DD, Garcia PA, Chang EF., Corpus callosotomy versus vagus nerve stimulation for atonic seizures and drop attacks: a systematic review. Epilepsy Behav (2015) 51:13–7. doi:10.1016/j.yebeh.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
86. Cukiert A, Cukiert CM, Burattini JA, Lima AM, Forster CR, Baise C, et al. Long-term outcome after callosotomy or vagus nerve stimulation in consecutive prospective cohorts of children with Lennox-Gastaut or Lennox-like syndrome and non-specific MRI findings., Napad padaczkowy (2013) 22(5):396-400. podoba mi się! do obserwowanych nr:610162013.02.009
PubMed Abstract | CrossRef Full Text | Google Scholar
87. Kwan SY, Lin JH, Wong TT, Chang KP, Yiu CH. Porównanie wyników napadów padaczkowych po callosotomii u pacjentów z zespołem Lennoxa-Gastauta z dodatnim lub ujemnym wywiadem dla zespołu Westa. Napad padaczkowy (2006) 15(7):552-7. podoba mi się! do obserwowanych nr:610162006.06.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
89. Katagiri M, Iida K, Kagawa K, Hashizume A, Ishikawa N, Hanaya R, et al. Combined surgical intervention with vagus nerve stimulation following corpus callosotomy in patients with Lennox-Gastaut syndrome. Acta Neurochir (Wien) (2016) 158(5):1005–12. doi:10.1007/s00701-016-2765-9
CrossRef Full Text | Google Scholar
93. Akman CI., Nonconvulsive status epilepticus and continuous spike and slow wave of sleep in children. Semin Pediatr Neurol (2010) 17(3):155–62. doi:10.1016/j.spen.2010.06.009
PubMed Abstract | CrossRef Full Text | Google Scholar
94. Walker M, Cross H, Smith S, Young C, Aicardi J, Appleton R, et al. Nonconvulsive status epilepticus: Epilepsy Research Foundation workshop reports. Epileptic Disord (2005) 7(3):253–96.,
PubMed Abstract | Google Scholar
98. Jurasek L, Ray L, Quigley D. Development and implementation of an adolescent epilepsy transition clinic. J Neurosci Nurs (2010) 42(4):181–9. doi:10.1097/JNN.0b013e3181e26be6
PubMed Abstract | CrossRef Full Text | Google Scholar
103. Ogawa K, Kanemoto K, Ishii Y, Koyama M, Shirasaka Y, Kawasaki J, et al., Długoterminowe badanie kontrolne zespołu Lennoxa-Gastauta u pacjentów z ciężką niepełnosprawnością ruchową i intelektualną: ze szczególnym uwzględnieniem problemu dysfagii. Napad padaczkowy (2001) 10(3):197-202. podoba mi się! do obserwowanych nr:1010532000.0483
CrossRef Full Text | Google Scholar
105. O ' Brien LM. Neurokognitywne skutki zaburzeń snu u dzieci i młodzieży. Child Adolesc Psychiatr Clin N Am (2009) 18(4):813-23. podoba mi się! do obserwowanych nr:601662009.04.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
109. Arzimanoglou A, Resnick T. Diagnosing and treating epileptic drop attacks, atypical absences and episodes of nonconvulsive status epilepticus. Epileptic Disord (2011) 13(Suppl 1):S1–2. doi:10.1684/epd.2011.0408
CrossRef Full Text | Google Scholar
110. Kivity S, Lerman P, Ariel R, Danziger Y, Mimouni M, Shinnar S., Długoterminowe wyniki poznawcze kohorty dzieci z kryptogennymi skurczami dziecięcymi leczonych wysokodawkowym hormonem adrenokortykotropowym. Epilepsja (2004) 45(3):255-62. doi:10.1111 / j. 0013-9580. 2004. 30503.x
PubMed Abstract | CrossRef Full Text | Google Scholar