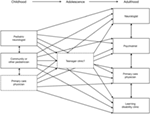
Figura 2. Esquema ilustrativo da crescente dispersão da prestação de cuidados na sequência da transição dos serviços pediátricos para os adultos (3). Reproduzido com permissão de John Libbey Eurotext.,
Outras Considerações para LGS de Gestão
síndrome de Lennox–Gastaut pacientes são prejudicados em sua vida diária, não só por uma variedade de apreensão tipos que muitas vezes são frequentes e fisicamente prejudicial (como a queda de ataques), mas também por uma série de graves comorbidades (3). As comorbidades que estão particularmente associadas com LGS incluem problemas cognitivos e comportamentais, deficiência física e distúrbios do sono., Cinco anos após o início do LGS, 75-95% dos pacientes têm deficiência cognitiva (101, 102), e problemas comportamentais, tais como hiperatividade, agressividade e traços autistas, desenvolvem-se em aproximadamente 50% (10). A mobilidade é muitas vezes severamente afectada por frequentes apreensões (particularmente ataques de queda), que são fisicamente exigentes e muitas vezes resultam em lesões (3). Os pacientes muitas vezes têm que fazer uso de equipamentos de proteção (como uma cadeira de rodas, capacete e/ou faceguard) para minimizar os efeitos físicos das convulsões. Por vezes, o uso de equipamentos de proteção (ex.,, permanecendo em uma cadeira de rodas para proteger contra lesões de ataques de queda) pode por si só afetar a mobilidade dos pacientes, alimentando-se em um círculo vicioso que limita a sua capacidade de ser fisicamente ativo. Além disso, o desenvolvimento precoce de disfagia está fortemente associado com mau prognóstico de crises a longo prazo (103), e afeta a capacidade dos pacientes para comer e tomar medicação.os doentes com LGS sofrem perturbações do ciclo do sono devido à ocorrência de crises nocturnas., A privação e/ou perturbação do sono afectam os mecanismos neurofisiológicos e neuroquímicos importantes para o processo de aprendizagem da memória (104), e podem também resultar numa vasta gama de deficiências comportamentais, cognitivas e do humor, incluindo hiperactividade, graus escolares reduzidos e depressão (105).a gestão cuidadosa das co-morbilidades no LGS é um aspecto central dos cuidados. Alguns AEDs podem causar ou exacerbar comorbidades (ex., por exemplo, benzodiazepinas usadas para tratar distúrbios do sono podem precipitar convulsões tônicas em LGS (106). Deve também considerar–se cuidadosamente o potencial de interacção medicamentosa com medicamentos utilizados no tratamento das co-morbilidades.,como resultado da carga substancial de convulsões e co-morbilidades, e dos efeitos colaterais de medicamentos associados, o QL de pacientes com LGS é prejudicado em muitos níveis (físico, mental, social) ao longo de suas vidas (3). O impacto físico da LGS, e as medidas preventivas tomadas para minimizar esse impacto, afetam severamente a capacidade dos pacientes de participar de atividades diárias, e a frequência escolar é muitas vezes interrompida. Problemas cognitivos e comportamentais muitas vezes exigem necessidades educativas e de cuidados específicos que irão prevenir a frequência escolar convencional (3)., Além disso, o referido impacto das crises nocturnas no sono pode prejudicar directamente o QoL dos doentes (107). Os efeitos da LGS na independência, capacidade de trabalho, participação social e relações pessoais continuam a prejudicar gravemente o QoL dos pacientes na idade adulta (3).,jor impacto sobre a Qv dos pais/encarregados de educação e famílias, devido à restrição da vida social e problemas de relacionamento entre os parceiros e outros membros da família; sentimentos de isolamento, o que pode levar à depressão; problemas de crianças, o que pode restringir ainda mais a participação social e oportunidades para descanso; exaustão física e/ou perturbações do sono; ansiedade sobre quando os ataques acontecem, as perspectivas futuras do indivíduo com LGS, e o estigma social associado com a condição; bem como dificuldades financeiras resultantes da renúncia de desenvolvimento de carreira em favor do cuidado (108).,uma vez que a LGS constitui um grande fardo para os pacientes e seus cuidadores/famílias, é necessária uma abordagem multidisciplinar e individualizada dos cuidados, que atende às necessidades médicas, educacionais, psicológicas e sociais de cada paciente ao longo de sua vida (109). Idealmente, as necessidades do paciente e de seu cuidador/família devem ser reavaliadas anualmente, levando em conta fatores como a saúde física do paciente, sua potencial necessidade de institucionalização (particularmente na idade adulta) e apoio ao cuidador/família.,
áreas para investigação futura
actualmente, os fármacos anti-epilépticos são medicamentos anti-convulsões e, portanto, tratam os sintomas da epilepsia em vez da(s) Sua (s) causa (s). Futuras pesquisas devem se concentrar em elucidar a história natural da LGS e se um tratamento adequado pode ter um impacto benéfico no seu curso de doença. Isto deve incluir não só os efeitos do tratamento farmacológico, mas também o papel dos procedimentos cirúrgicos como a callosotomia., Sugere-se que o controlo precoce das crises na LGS esteja associado a melhores resultados neurocognitivos (2), mas a relevância destes resultados na LGS de novo, bem como o impacto da supressão das crises em crianças mais velhas e adultos, é menos certa, e é uma área que merece um estudo mais aprofundado. Embora actualmente seja dada atenção aos potenciais efeitos prejudiciais dos AEDs na cognição, é necessária investigação para elucidar se outros tratamentos não AED podem proteger contra a deficiência cognitiva e/ou melhorar a cognição em doentes com LGS., Além disso, a pesquisa é necessária para desenvolver ferramentas padronizadas para os prestadores de cuidados para medir rotineiramente mudanças no desempenho cognitivo e comportamento dos pacientes ao longo do tempo. Também é necessária elucidação quanto à existência de genótipos específicos ou mutações genéticas que determinem a susceptibilidade aos LGS, o que poderia direcionar o desenvolvimento de ferramentas de diagnóstico.dados os problemas associados à contagem de convulsões em LGS (devido à frequência de ataques de queda, duração de crises de ausência, etc.,), deve avaliar-se o valor preditivo da utilização de objectivos alternativos em ensaios clínicos, como o número de dias sem crises, em vez da frequência per se de crises. A caracterização de fatores que predizem a resposta ao tratamento em pacientes com LGS também seria valiosa nas configurações de pesquisa e prática clínica. Outras áreas potenciais de pesquisa futura incluem a relevância da terapia com esteróides em LGS , e se ela pode melhorar a cognição, e os efeitos a longo prazo do tratamento com canabidiol em LGS, em termos de AEs e o potencial desenvolvimento de tolerância.,
Autor Contribuições
Todos os autores (CA, SA, MF, PS, e AA) fez contribuições substanciais para a concepção deste artigo, e a análise e interpretação dos dados que ele contém; foram envolvidos na redação do artigo ou revisão crítica relevante do conteúdo intelectual; desde a aprovação final da versão a ser publicada; e concordou em ser responsável por todos os aspectos do trabalho para assegurar que as questões relacionadas com a exatidão ou a integridade de qualquer parte do trabalho foram adequadamente investigados e resolvidos.,a JC tem assento em conselhos consultivos para Eisai, UCB, Shire, Zogenix, Vitaflo e Nutricia, para os quais foram pagos pagamentos e honorários ao seu departamento. Ela participou como uma investigadora para Vitaflo, GW Pharmaceuticals, e Zogenix, com fundos pagos para seu departamento. Ela também recebeu fundos de pesquisa de Vitaflo. Ela é apoiada pelo National Institute for Health Research Biomedical Research Centre no Great Ormond Street Hospital for Children NHS Foundation Trust e University College London., A SA tem assento em conselhos para Eisai, GSK, Novartis, Nutricia, Shire, Ultragenyx, e Zogenix. Ele participou como investigador da Advicenne Pharma, Eisai, UCB, Ultragenyx, e Zogenix, com fundos pagos para seu hospital ou seu laboratório de pesquisa. A MF participou como investigadora da UCB, GW Pharmaceuticals, Pfizer e LivaNova, com fundos pagos ao seu departamento. Ela recebeu fundos de pesquisa de Eisai, UCB, LivaNova e Esteve, com fundos pagos ao seu departamento. Recebeu honorária de Eisai, UCB, LivaNova, Bial e Esteve., PS recebeu honoraria da FB Health, Kolfarma s. r. l., UCB Pharma, e Eisai Inc., e apoio de pesquisa do Ministério da saúde italiano e da Fundação Telethon. AA recebeu bolsas de pesquisa da Comissão Europeia, UCB Pharma, e CaixaBank, com fundos pagos para o seu departamento, e taxas de consultoria de Eisai, GW, Shire, Takeda, Zogenix, e UCB Pharma.
agradecimentos
Suporte Editorial para a preparação deste manuscrito foi fornecido por John Scopes of mXm Medical Communications.,a reunião do grupo de consenso para o desenvolvimento desta publicação foi organizada e financiada pela Eisai Ltd. O apoio Editorial para a preparação desta publicação foi financiado pela Eisai Ltd. As opiniões expressas neste artigo são as opiniões consensuais independentes dos autores e não foram influenciadas pelo patrocínio de terceiros.
Abreviaturas
Rodapé
2. Arzimanoglou a, Resnick T. todas as crianças que sofrem de quedas epilépticas não têm necessariamente síndrome de Lennox-Gastaut… mas muitos têm., Epileptic Disord (2011) 13(Suppl 1):S3–13. doi:10.1684/epd.2011.0422
CrossRef Full Text | Google Scholar
3. Kerr M, Kluger G, Philip S. Evolution and management of Lennox-Gastaut syndrome through adolescence and into adulthood: are seizures always the primary issue? Epileptic Disord (2011) 13(Suppl 1):S15–26. doi:10.1684/epd.2011.0409
PubMed Abstract | CrossRef Full Text | Google Scholar
5., Goldsmith IL, Zupanc ML, Buchhalter JR. Long-term seizure outcome in 74 patients with Lennox-Gastaut syndrome: effects of incorporating MRI head imaging in defining the cryptogenic subgroup. Epilepsia (2000) 41(4):395–9. doi:10.1111/j.1528-1157.2000.tb00179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
8. International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes., Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia (1989) 30(4):389–99. doi:10.1111/j.1528-1157.1989.tb05316.x
CrossRef Full Text | Google Scholar
10. van Rijckevorsel K. Treatment of Lennox-Gastaut syndrome: overview and recent findings. Neuropsychiatr Dis Treat (2008) 4(6):1001–19. doi:10.2147/NDT.,S1668
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gastaut H, Dravet C, Loubier D. Evolution clinique et prognostic du syndrome de Lennox-Gastaut. In: Lugaresi E, Pazzaglia P, Tassinari CA, editors. Evolution and Prognosis of Epilepsies. Bologna, Italy: Aulo Gaggi (1973). p. 133–54.
Google Scholar
17. EuroEPINOMICS-RES Consortium, Epilepsy Phenome/Genome Project, Epi4K Consortium., De novo mutations in synaptic transmission genes including DNM1 cause epileptic encephalopathies. Am J Hum Genet (2014) 95(4):360–70. doi:10.1016/j.ajhg.2014.08.013
CrossRef Full Text | Google Scholar
18. Epilepsy Phenome/Genome Project Epi4K Consortium. Copy number variant analysis from exome data in 349 patients with epileptic encephalopathy. Ann Neurol (2015) 78(2):323–8. doi:10.1002/ana.,24457
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Larsen J, Johannesen KM, Ek J, Tang S, Marini C, Blichfeldt S, et al. The role of SLC2A1 mutations in myoclonic astatic epilepsy and absence epilepsy, and the estimated frequency of GLUT1 deficiency syndrome. Epilepsia (2015) 56(12):e203–8. doi:10.1111/epi.13222
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Hughes JR, Patil VK., Long-term electro-clinical changes in the Lennox-Gastaut syndrome before, during, and after the slow spike-wave pattern. Clin Electroencephalogr (2002) 33(1):1–7. doi:10.1177/155005940203300103
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Doose H. Myoclonic-astatic epilepsy. Epilepsy Res Suppl (1992) 6:163–8.
PubMed Abstract | Google Scholar
26. Patry G, Lyagoubi S, Tassinari CA., Subclinical “electrical status epilepticus” induced by sleep in children. A clinical and electroencephalographic study of six cases. Arch Neurol (1971) 24(3):242–52. doi:10.1001/archneur.1971.00480330070006
CrossRef Full Text | Google Scholar
28. King DW, Smith JR. Supplementary sensorimotor area epilepsy in adults. Adv Neurol (1996) 70:285–91.
PubMed Abstract | Google Scholar
29., Khan SA, Carney PW, Archer JS. Breve postura tônica assimétrica com atividade rápida difusa de baixa tensão em crises decorrentes da região parietal mesial. Epilepsia Res (2014) 108(10):1950-4. doi: 10.1016 / j. eplepsyres.2014.09.011
PubMed Resumo | CrossRef Texto Completo | Google Scholar
33. Síndrome de Ohtahara S. Lennox-Gastaut. Considerações em seu conceito e categorização. JPN J Psychiatry Neurol (1988) 42(3):535-42.,
PubMed Abstract | Google Scholar
35. Pujar S, Calvert S, Cortina-Borja M, Chin RF, Smith RA, Cross JH, et al. Statistical process control (SPC) – a simple objective method for monitoring seizure frequency and evaluating effectiveness of drug interventions in refractory childhood epilepsy. Epilepsy Res (2010) 91(2–3):205–13. doi:10.1016/j.eplepsyres.2010.07.013
CrossRef Full Text | Google Scholar
39., Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry (2006) 77(2):193–8. doi:10.1136/jnnp.2005.074203
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Motte J, Trevathan E, Arvidsson JF, Barrera MN, Mullens EL, Manasco P, et al. Lamotrigine for generalized seizures associated with the Lennox-Gastaut syndrome., N Engl J Med (1997) 337(25):1807–12. doi:10.1056/NEJM199712183372504
CrossRef Full Text | Google Scholar
46. The Felbamate Study Group in Lennox-Gastaut Syndrome. Efficacy of felbamate in childhood epileptic encephalopathy (Lennox-Gastaut syndrome). N Engl J Med (1993) 328(1):29–33. doi:10.1056/NEJM199301073280105
CrossRef Full Text | Google Scholar
52., Ohtsuka Y, Yoshinaga H, Shirasaka Y, Takayama R, Takano H, Iyoda K. de segurança a Longo prazo e apreensão resultado em Japonês pacientes com síndrome de Lennox-Gastaut receber adjuvante rufinamide terapia: um estudo aberto depois de um ensaio clínico randomizado. Epilepsia Res (2016) 121:1-7. doi: 10.1016 / j. eplepsyres.2016.01.002
PubMed Resumo | CrossRef Texto Completo | Google Scholar
55. Conry JA, Ng YT, Kernitsky L, Mitchell WG, Veidemanis R, Drummond R, et al., As dosagens estáveis de clobazam para a síndrome de Lennox-Gastaut estão associadas a uma perda prolongada e a melhorias nas crises totais ao longo de 3 anos. Epilepsia (2014) 55(4):558-67. doi: 10.1111/epi.12561
CrossRef Texto Completo | Google Scholar
56. Munn R, Camfield P, Camfield C, Dooley J. Clobazam for refractory childhood convulsion disorders-a valuable supplementary drug. Pode J Neurol Sci (1988) 15(4):406-8.,
Google Scholar
60. Hussain SA, Zhou R, Jacobson C, Weng J, Cheng E, Lay J, et al. Perceived efficacy of cannabidiol-enriched cannabis extracts for treatment of pediatric epilepsy: a potential role for infantile spasms and Lennox-Gastaut syndrome. Epilepsy Behav (2015) 47:138–41. doi:10.1016/j.yebeh.2015.04.009
PubMed Abstract | CrossRef Full Text | Google Scholar
62., Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Interacção fármaco-fármaco entre o clobazam e o canabidiol em crianças com epilepsia refractária. Epilepsia (2015) 56(8):1246-51. doi: 10.1111/epi.13060
PubMed Resumo | CrossRef Texto Completo | Google Scholar
de 65 anos. Biró a, Stephani U, Tarallo T, Bast T, Schlachter K, Fleger M, et al. Eficácia e tolerabilidade do perampanel em crianças e adolescentes com epilepsia refractária: primeiras experiências. Neuropediatria (2015) 46(2):110-6. doi: 10.,1055/s-0035-1546276
PubMed Resumo | CrossRef Texto Completo | Google Scholar
69. Lemmon ME, Terao NN, Ng YT, Reisig W, Rubenstein JE, Kossoff EH. Eficácia da dieta cetogénica na síndrome de Lennox-Gastaut: uma revisão retrospectiva da experiência de uma instituição e resumo da literatura. Dev Med Child Neurol (2012) 54(5):464-8. doi: 10.1111 / J. 1469-8749. 2012. 04233.,x
PubMed Abstract | CrossRef Full Text | Google Scholar
72. Sharma S, Jain P, Gulati S, Sankhyan N, Agarwala A. Use of the modified Atkins diet in Lennox Gastaut syndrome. J Child Neurol (2015) 30(5):576–9. doi:10.1177/0883073814527162
PubMed Abstract | CrossRef Full Text | Google Scholar
76. Chambers A, Bowen JM. Electrical stimulation for drug-resistant epilepsy: an evidence-based analysis., Ont Health Technol Assessment Ser (2013) 13(18):1-37.
PubMed Resumo | Google Scholar
77. Morris GL III, Gloss D, Buchhalter J, Mack KJ, Nickels K, Harden C. Evidence-based guideline update: vago nerve stimulation for the treatment of epilepsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurologia (2013) 81(16):1453-9. doi: 10.1212 / WNL.,0b013e3182a393d1
CrossRef Full Text | Google Scholar
78. Karceski S. Vagus nerve stimulation and Lennox-Gastaut syndrome: a review of the literature and data from the VNS patient registry. CNS Spectr (2001) 6(9):766–70. doi:10.1017/S1092852900001516
PubMed Abstract | CrossRef Full Text | Google Scholar
84. Rolston JD, Englot DJ, Wang DD, Garcia PA, Chang EF., Corpus callosotomy versus vagus nerve stimulation for atonic seizures and drop attacks: a systematic review. Epilepsy Behav (2015) 51:13–7. doi:10.1016/j.yebeh.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
86. Cukiert A, Cukiert CM, Burattini JA, Lima AM, Forster CR, Baise C, et al. Long-term outcome after callosotomy or vagus nerve stimulation in consecutive prospective cohorts of children with Lennox-Gastaut or Lennox-like syndrome and non-specific MRI findings., Convulsão (2013) 22(5):396-400. doi: 10.1016 / j. convulsão.2013.02.009
PubMed Resumo | CrossRef Texto Completo | Google Scholar
87. Kwan SY, Lin JH, Wong TT, Chang KP, Yiu CH. Uma comparação do resultado das convulsões após a calosotomia em doentes com síndrome de Lennox-Gastaut e uma história positiva ou negativa para a síndrome de West. Convulsão (2006) 15(7):552-7. doi: 10.1016 / j. convulsão.2006.06.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
89. Katagiri M, Iida K, Kagawa K, Hashizume A, Ishikawa N, Hanaya R, et al. Combined surgical intervention with vagus nerve stimulation following corpus callosotomy in patients with Lennox-Gastaut syndrome. Acta Neurochir (Wien) (2016) 158(5):1005–12. doi:10.1007/s00701-016-2765-9
CrossRef Full Text | Google Scholar
93. Akman CI., Nonconvulsive status epilepticus and continuous spike and slow wave of sleep in children. Semin Pediatr Neurol (2010) 17(3):155–62. doi:10.1016/j.spen.2010.06.009
PubMed Abstract | CrossRef Full Text | Google Scholar
94. Walker M, Cross H, Smith S, Young C, Aicardi J, Appleton R, et al. Nonconvulsive status epilepticus: Epilepsy Research Foundation workshop reports. Epileptic Disord (2005) 7(3):253–96.,
PubMed Abstract | Google Scholar
98. Jurasek L, Ray L, Quigley D. Development and implementation of an adolescent epilepsy transition clinic. J Neurosci Nurs (2010) 42(4):181–9. doi:10.1097/JNN.0b013e3181e26be6
PubMed Abstract | CrossRef Full Text | Google Scholar
103. Ogawa K, Kanemoto K, Ishii Y, Koyama M, Shirasaka Y, Kawasaki J, et al., Estudo de acompanhamento a longo prazo da síndrome de Lennox-Gastaut em doentes com graves deficiências motoras e intelectuais: com especial referência ao problema da disfagia. Convulsão (2001) 10(3):197-202. doi: 10.1053 / seiz.2000.0483
CrossRef Texto Completo | Google Scholar
105. O’Brien LM. Os efeitos neurocognitivos da perturbação do sono em crianças e adolescentes. Child Adolesc Psychiatr Clin N Am (2009) 18(4):813-23. doi: 10.1016 / j. chc.2009.04.,008
PubMed Abstract | CrossRef Full Text | Google Scholar
109. Arzimanoglou A, Resnick T. Diagnosing and treating epileptic drop attacks, atypical absences and episodes of nonconvulsive status epilepticus. Epileptic Disord (2011) 13(Suppl 1):S1–2. doi:10.1684/epd.2011.0408
CrossRef Full Text | Google Scholar
110. Kivity S, Lerman P, Ariel R, Danziger Y, Mimouni M, Shinnar S., Resultados cognitivos a longo prazo de uma coorte de crianças com espasmos infantis criptogénicos tratados com hormona adrenocorticotrópica de dose elevada. Epilepsia (2004) 45(3):255-62. doi: 10.1111 / J. 0013-9580. 2004. 30503.x
PubMed Abstract | CrossRef Full Text | Google Scholar